Mikrobiota bağırsaktaki bakteri, virüs ve parazitlerin toplamına verilen bir isimdir. Giderek artan kanıtlar, bağırsak mikrobiotasının nöropsikiyatrik hastalıkların oluşumundan sorumlu tutmaktadır (1). Bültenimizin bu bölümünde bağırsak ve beyin arasındaki etkileşim üzerinde durulacak.
Bağırsak beyni nasıl etkiliyor ?
Bağırsaklar artık ikinci bir beyin olarak görülmektedir. Beynimizde 80 milyar sinir hücresi var iken bağırsaktaki sinir hücresi sayısının 500 milyon olduğu kabul edilmektedir. Bağırsak ile beyin arasındaki iletişim birkaç farklı yoldan çift yönlü olarak sağlanır. Bağırsakta üretilen hormonlar, bağışıklık hücreleri, mikrobiota, mikrobiotanın ürünleri (GABA, seratonin, kısa zincirli yağ asitleri) ve beyinden bağırsağa gelen vagus isimli sinir iki organ arasındaki başlıca iletişim yollarıdır (Şekil 1).
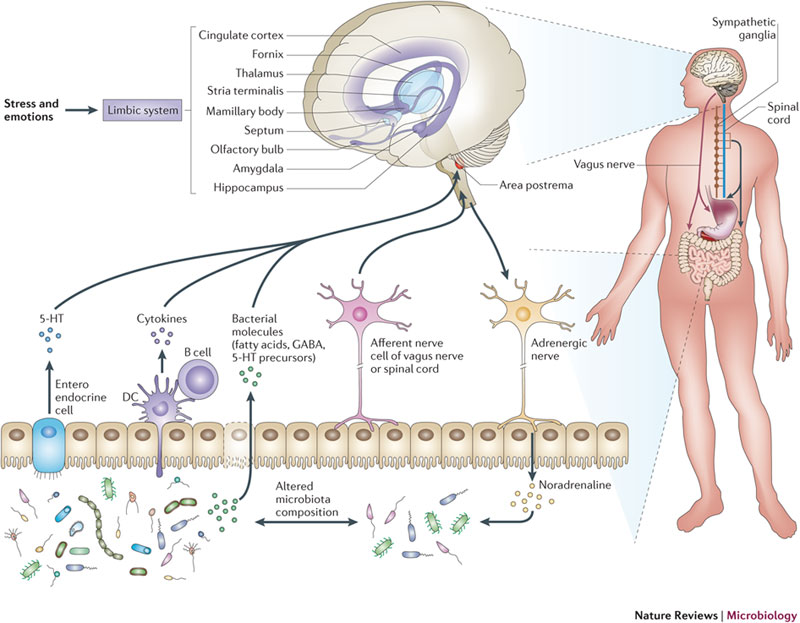
Şekil 1. Bağırsak ve beyin arasındaki etkileşim yolları (Nature Reviews)
Bağırsak sızdırma hipotezi
Bağırsaktan kan dolaşımına, zararlı maddelerin geçişini engelleyen bariyer adını verdiğimiz bir yapı vardır. Bu bariyer sıkı bağlantı proteinleri, mukus tabakası, savunma hücreleri ve faydalı bakterilerden oluşur (1, 2).
Bağırsaktaki bariyerin bozulması ve bağırsak geçirgenliğinin artışı bu gün otizm, dikkat eksikliği, hasas bağırsak sendromu, astım, multipl skleroz, depresyon, anskiyete, Parkinson, Alzheimer hastalığı gibi pek çok hastalığın temelin yer aldığı ileri sürülmektedir (şekil 2).
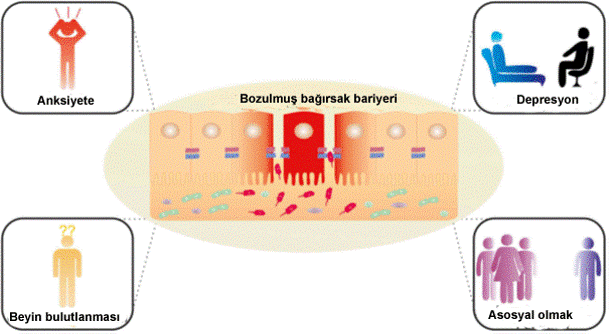
Şekil 2. Bağırsak sızdırma hipotezi ve psikiyatrik hastalıklar
Bağırsak hücrelerini sıkılaştıran, bir arada tutan geçirgenliği azaltan proteinler vardır. Bu sıkı bağlantı proteinleri: claudin, occludin, tricullulin. (2, 3).
Bağırsaktaki bu proteinler gebeliğin ilk 10.hafta görülür, ilk 3 ayının sonunda gelişir. (3, 4). Doğum sonrası bağırsak bariyerinin gelişimi, beslenme şekli ve içeriğinden etkilenerek devam eder (5, 6). Bu gelişim mikrobiotanın gelişimi ile paraleldir. Mikrobiota 3 yaşında erişkin düzeyine ulaşır (7). Mikrobiotanın gelişiminde etkili diğer faktörler doğum şekli, doğum zamanı, antibiotik kullanımı, beslenme şekli, aile üyeleri ve ev içi hayvanlar ile karşılaşmadır. (8-12). Mikrobiotanız kötü ise bağırsak bariyerinizde kötüdür.
Ruh hali, depresyon ve saldırganlık durumunun kontrol edilmesinde görev yapan Serotonin beyin-barsak mikrobiota aksında önemli bir sinyal molekülüdür (13). Sindirim sistemi sekresyonları ve sinyallerinde önemli rol oynar (14). Bağırsaktaki enterokromafin hücreler serotonin (5-HT) için kaynak hücreleridir (15). Mukozal serotonin bağırsak geçirgenliğinin ayarlanmasında doğrudan rolü olduğu gösterilmiştir. 5HTP, 5-HT nin öncülüdür, bağırsak geçirgenliğini azaltır. Bağırsak mikrobiotası 5-HT sentezini ve sekresyonunu regüle eder (16). Tüm vücutta üretilen serotonin büyük çoğunluğu (%95) bağırsakta, çok azı (% 5) beyinde üretilir. Serotonin artışı yapan depresyon ilaçlarının sindirim ile ilgili yakınma oluşturması bundandır.
İlginç bir bilgi: Beyin kan bariyeri, bağırsak bariyeri ile aynı proteinlere sahip
Bağırsakta olduğu gibi plasenta ve beyinde de benzer bir bariyer vardır (17). Bağırsakta olduğu gibi kan beyin bariyerinin yapısında sıkı bağlantı proteinleri vardır. Hücreler arası geçirmezliği sağlar. İlginçtir, bu proteinler bağırsaktaki proteinler ile aynıdır (18). Beyin bariyerinin de sıkı olması gerekir. Ancak bağırsak bariyerindeki değişimlerden beyin bariyeri de olumsuz olarak etkilenir.
Bağırsak yüzeyini kaplayan mukus tabakası da barsak bariyeri için önemli
Kalın bağırsaktaki mukus tabakası iki kattan oluşur. Fiziksel bir bariyerdir. Bu tabakalardaki mukus glikozilenmiş jel yapısından bir proteindir. Mukus tabakası sekretuar IgA antikoru ve hücrelerden bakterilerin geçişini önleyen antimikrobial peptidler içerir. Mukus tabakası goblet hücreleri tarafından yapılır, iç tabaka her saat yenilenir (19) (Şekil 2). Bu dinamik süreçlerin sağlıklı yürümesinde yine mikrobiotanın ciddi bir etkileşimi vardır (20, 21).
Bağırsak bakterileri strese olan cevabımızı belirliyor
Bebek iken bağırsak mikrobiotasının gelişme gösterememesi veya daha sonradan kötü yönde değişme göstermesi bağırsak-beyin iletişimindeki sinyal yolunu etkiler. Bu durum erişkinde stres ile ilgili hastalıklara eğilim yaratabilir (22). Mikrobiotadan yoksun hayvalarda anksiyetenin daha az görüldüğü, ancak stres ile karşılaşınca hormonal cevabın aşırı olduğu gösterilmiş (23). Mikrobiotanın en belirgin etkileri yaşamın erken dönemlerinde beyin gelişimi döneminde olur (22).
Stres bağırsak geçirgenliğini artırabilir, kötü mikrobiota strese vücudun tepkisini artırabilir
Stres bağırsak geçirgenliğinin gelişim yönünü etkileyerek bağırsağı geçirgen hale getirebilir (24, 25 ). İnsan çalışmaları strese cevap olarak anlamlı yükselmiş kortizol yanıtının özellikle kalın bağırsak permabilitesini bozduğunu göstermiştir (26, 27). Stresin beyinin hipotalamus-hipofiz bölgesi ve otonom sinir sistemi üzerindeki etkileri probiotiklere duyarlıdır (28). İnsan çalışmaları strese cevap olarak anlamlı yükselmiş kortizol yanıtının ince bağırsak geçirgenliğini artırdığı gösterilmiştir.
Spastik (İritabl) bağırsak sendromunda (IBS) stres ile ilgili fonksiyonel beyin-barsak mikrobiota aks hastalığıdır. IBS de bağırsak geçirgenliği artmıştır. IBS hastalarının büyük bir çoğunluğu depresyon ve anksiyete içindedir (29, 30). Gastrointestinal semptomların şiddeti ve sıklığı artıkça psikiyatrik semptomlar da artar. Firmicutes:Bacteroides oranının değişmesi irritabl bağırsak sendromu ile ilişkilidir. Oran artıkça depresyon artar (31).
Bağırsak mikrobiotası vücudun savunma hücrelerini uyararak bağırsak geçirgenliğini artırabilir
Vücudun savunma sistemi (immun sistem) ile mikrobiota ve bağırsak bariyeri arasındaki ilişki yaşa boyu sürer. Bağırsak mikrobiotasındaki kötü yöndeki değişiklikler savunma hücreleri üzerinden bağırsak geçirgenliğini artırabilir. Kronik düşük düzey iltihabi reaksiyon, ruh halimizi ve beyin fonksiyonlarımızı olumsuz etkiler (32).
Mikrobiyota ile immun sistem arasındaki ilişki bununla sınırlı değildir. İmmun sistemin bağırsaklardaki temel hücrelerinden biri olan dendritik hücreler uzantılarını bağırsak hücreleri arasından barsak lümeni içine uzatırlar ve lümendeki bakterileri ve onların ürünlerini toplarlar. Bu içerik lenf bezlerinde diğer hücrelere aktarılır. Bu hücreler kan dolaşımına katılırlar ve kan beyin bariyerini aşarak beyne geçebilirler. Bu durum nöronların elektriksel aktivitesinde değişiklikler yapar (33). Bu cümle kısaca anlatmak istediğim bağırsaktaki savunma hücresi bağırsaktaki bakterilerin ürünlerini alıp, beyin hücrelerine taşır ve bu durum beyin hücrelerini etkiler.
Bakterilerin ürettiği kısa zincirli yağ asitleri faydalı da olabilir zararlı da
Mikrobiota birkaç bioaktif metabolit (polisakarid, seramid, nükleik asit, kısa zincirli yağ asitleri) üretir ( 34, 35). Kısa zincirli yağ asitler (butirat, asetat, propionat) nörohumoral sinyal molekül özelliğine sahiptir. Bağırsakta kolonize olmuş bakterilerin ürettiği kısa zincirli yağ asitleri (butirat) ön beyin ve hafız bölümünde (hipokampus) yer alan bariyeri sıkılaştırır ve bu durum zekamızı ve öğrenmemizi iyi yönde etkiler (36).
Kısa zincirli yağ asitlerinin obeziteyi önleyici etkisi
Butirat ve propionat obeziteyi önleyici etkiye sahiptir. Butirat kalın bağırsak hücrelerinin beslenmesinde kullanılır. İnsulin duyarlılığını artırır, iştahı azaltmadan obeziteyi önler. Bağırsak geçirgenliğini azaltır. Propionat kolesterol sentezini inhibe eder, yağ dokusunda resistin hormonunun (Kötü kolesterolü artırıcı özelliğe sahip) salınımını azaltır. Her iki yağ asiti, bağırsaktaki iştah kesici hormonlar ve leptin üzerinden kiloyu kontrol altında tutar. Bağırsakta Bakteriodes, Firmicutes ve Actinobakteria olmak üzere 3 bakteri grubu bulunur. Obezitede bakteriodes grubu azalırken, firmicutes ve actinobakter grubu artar (37, 38). Diyet yapıyorum ama zayıflayamıyorum diyen pek çok insan için bu bilgiler önemli olabilir.
Kısa zincirli yağ asitlerinin otizim üzerine olumsuz etkisi
Otistik farelerde bir bakteri metaboliti olan 4-etilfenilsülfat düzeyi serumda yüksek saptanmıştır. Bu maddenin normal farelere verilmesiyle otistik davranışların ortaya çıktığı gözlenmiştir (39). Bu olağanüstü deney ve elde edilen çarpıcı sonuç Nature dergisinde önemli bir gelişme olarak bilim dünyasına duyurulmuştur (40). Otistik çocuklarda bifidobakter türlerinde düşüklük, lactobacillus türlerinde yükseklik (41) ve ayrıca bacteroides türlerinde de yükseklik (42) saptanmıştır. Yüksek karbonhidratlı beslenme sonucunda bağırsaklarda kısa zincirli yağ asitlerinin üretiminin arttığı ve bunların sistemik dolaşıma karışmasıyla otistik davranışlara neden olduğu yönünde görüşler de vardır (43).
Polifenoller
Polifenoller flavanoidler ve nonflavanoidler olmak üzere 2 gruba ayrılır. En büyük grubu flavanoidler oluşturur. Alınan polifenollerin % 5-10 u ince barsaktan emilir. Geri kalan hiç değişmeden kalın barsağa geçer. Burada barsak bakterileri tarafından enzimatik olarak parçalanır ve molekül çapları küçülür ve absorbe edilir (44-46). Kalın bağırsakta 1 gram feçeste 500-1000 çeşit bakteri türü vardır. Bununla birlikte yalnızca birkaç bakteri türü (E.coli, Bifidiobakterium, Laktobacillus, Bacteriodes) fenolleri metabolize eder (47). Polifenoller paslanmayı, kanseri, yağlanmayı, diyabeti önleyici ve nöronları koruyucu etkiye sahiptir (48-54). Bununla birlikte polifenollerin bağırsak mukus salgısını artırarak bağırsak bariyerini güçlendirdiği bilinmektedir.
Kalın barsakta emilmeyen flavanoidlerin % 90-95 i bakteriler tarafından parçalanır. Oluşan ürünlerin farklı etkileri vardır (55). Şarap, çay ve çikolata flavonoid açısından çok zengindir. Kakoa diyetinin Bacteroides, Clostridium and Staphylococcus gibi zararlı bakteri türlerini azalttığı görülmüştür (56).
Flavanoid olmayan polifenol bileşikler (tannin) çilek, ahududu, ceviz, şarap ve narda bol bulunur. Elagitaninler barsak lümeninde bakteriler tarafından ellagic aside metabolize edilir. Kalın barsakta elagitaninler tekrar metabolize edilirler. Tüm fenolik bileşikler ya feçesle atılır, ya da kalın barsakta emilir portal dolaşım ile karaciğere gelir burada metabolize olur ve kan dolaşımına geçer.
Bağırsaklarımızdaki bacteriodes / firmicutes oranının azalması istenmeyen bir durumdur. Polifenoller barsak mikrobiotasını değiştirir, bacteriodes / firmicutes oranını dengeler. Yamakoshi ve arkadaşları (57) 2 hafta süre ile üzüm çekirdeği tüketen erişkinlerde bifidobakterilerin sayısının artığını göstermiştir. Bununla birlikte günümüzdeki laboratuar çalışmalarında çikolata, yeşil çay, frenk üzümü veya üzüm çekirdeğinin bağırsak mikrobiotayı modüle ettiği clostriumu bakterisini azaltırken, laktobasillius sayısını artırdıkları görülmüştür (58-61). Bu nedenle özellikle nöropsikiyatrik yakınmaları olan hastaların polifenolden zengin gıdaları alması önerilir.
Bu konuda daha söylenecek çok şey var. Probiotik, prebiotikler, sütteki kazein ile ilgili başka bir yazı ile devam edeceğiz.
Doç.Dr. Hasan Önal
Kaynaklar
- Nicholson JK, Holmes E, Wilson ID.(2005).Gut microorganisms, mammalian metabolism and personalized health care. Nat.Rev.Microbiol. 3, 431–438.
- Borre YE, O’Keeffe GW, Clarke G,Stanton C, Dinan TG, Cryan JF (2014). Microbiota and neuro developmental windows:implications for brain disorders. Trends Mol.Med. 20, 509–518.
- Dörfel MJ, Huber O.(2012).Modulation of tight junction structure and function bykinases and phosphatases targeting occludin. J. Biomed.Biotechnol. 2012:807356.
- Montgomery RK, Mulberg AE, Grand RJ.(1999).Development of the human gastrointestinal tract:twenty years of progress. Gastroenterology 116, 702–731.
- Louis NA, Lin PW.(2009).The intestinal immune barrier. Neoreviews 10, e180–e190.
- Cummins AG, Thompson FM.(2002).Effect of breast milk and weaning on epithelial growth of the small intestine in humans. Gut 51, 748–754.doi: 10.1136/gut.51.5.748
- Verhasselt,V.(2010).Neonatal tolerance under breast feeding influence:the presence of allergen and transforming growth factor-betain breastmilk protects the progeny from allergic asthma. J. Pediatr. 156, S16–S20.
- Voreades N, Kozil A, Weir TL.(2014).Diet and the development of the human intestina lmicrobiome. Front. Microbiol. 5:494.
- Barrett E, Kerr C, Murphy K, O’Sullivan, O Ryan CA,Dempsey EM., et al.(2013).The individual-specific and diverse natüre of the preterm infant microbiota. Arch.Dis.Child.FetalNeonatalEd. 98, F334–F340.
- Dominguez-Bello, MG, Costello, EK, Contreras M, Magris M, Hidalgo G, Fierer N., et al. (2010). Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc. Natl. Acad.Sci.U.S.A.107,11971–11975.
- Penders, J, Thijs C, Vink C, Stelma, FF, Snijders, B, Kummeling I, et al. (2006).Factors influencing the composition of the intestinal microbiota in early infancy.Pediatrics118,511–521.
- Fujimura, KE, Slusher, NA, Cabana, MD, Lynch, SV. (2010). Role of the gut microbiota in defining human health. Expert Rev. Anti Infect. Ther. 8, 435–454.
- Marques, TM, Wall R, Ross, RP, Fitzgerald, GF, Ryan, CA, Stanton C. (2010). Programming infant gut microbiota: influence of dietary and environmental factors. Curr. Opin. Biotechnol. 21, 149–156.
- O’Mahony, SM, Clarke G, Borre YE, Dinan, TG, Cryan, JF. (2015). Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behav. Brain Res.277,32–48.
- Mawe GM, Hoffman JM.(2013).Serotoninsignallinginthegut–functions, dysfunctions and therapeutic targets. Nat. Rev. Gastroenterol. Hepatol. 10, 473 486. Berger M, Gray, JA,and Roth BL.(2009).The expanded biology of serotonin. Annu.Rev.Med.60,355–366.
- Reigstad CS, Salmonson CE, Rainey JFIII, Szurszewski, JH, Linden, D R, Sonnenburg JL, et al. (2015). Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells.FASEBJ. 29,1395–1403.
- Doran KS, Banerjee A, Disson O, Lecuit M. (2013). Concepts and mechanisms:crossing host barriers. Cold Spring Harbor Perspect. Med. 3.
- Hawkins BT, Davis TP. (2005). The blood-brain barrier/neurovascular un it in health and disease.Pharmacol.Rev.57,173–185.
- Johansson MEV, Larsson JMH, Hansson GC.(2011).Thetwomucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host–microbial interactions. Proc. Natl. Acad. Sci. U.S.A. 108, 4659–4665.
- Yu, LC, Wang, JT, Wei SC, Ni, YH. (2012). Host-microbial interactions and regulation of intestinal epithelial barrier function: from physiology to pathology. World J. Gastrointest. Pathophysiol. 3, 27–43.
- Bischoff, SC, Barbara G, Buurman W, Ockhuizen T, Schulzke JD, Serino M, et al.(2014).Intestinal permeability–a new target for disease prevention and therapy. BMCGastroenterol.14:189.
- Borre YE, O’Keeffe GW, Clarke G, Stanton C, Dinan TG, Cryan JF. (2014). Microbiota and neuro developmental windows: implications for brain disorders.Trends Mol.Med.20,509–518.doi:10.1016/j.molmed.2014.05.00.
- Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN, et al. (2004).Postnatal microbial colonization programs the hypothalamic-pituitary adrenal system for stress response in mice. J. Physiol. 558, 263–275.
- Smith F, Clark JE, Overman BL, Tozel CC, Huang JH, Rivier JEF, et al. (2010). Early weaning stress impairs development of mucosal barrier functionint heporcine intestine.Am.J.Physiol.Gastrointest.LiverPhysiol.298, G352 G363.
- Lennon EM, Maharshak N, Elloumi H, Borst L, Plevy SE, Moeser, AJ.(2013).Early life stress triggers persistent colonic barrier dysfunction and exacerbates colitisin adultIL-10-/-mice.Inflamm.BowelDis.19,712–719.
- Park AJ, Collins J, Blennerhassett, PA, Ghia JE, Verdu EF, Bercik P, et al. (2013). Altered colonic function and microbiota profile in a mouse model of chronic depression. Neurogastroenterol. Motil. 25, 733–e575.
- Vanuytsel, T., van Wanrooy, S., Vanheel, H., Vanormelingen, C., Verschueren, S., Houben, E., et al. (2014). Psychological stress and corticotropin-releasing hormone increase intestinal permeability in humans by a mast cell-dependent mechanism.Gut 63,1293–1299.
- Ait-Belgnaoui A, Colom A, Braniste V, Ramalho L, Marrot, A, Cartier C., et al. (2014). Probiotic gut effect prevents the chronic psychological stressinduced brain activity abnormality in mice. Neurogastroenterol. Motil. 26, 510–520.
- Singh P, Agnihotri A, Pathak MK, Shirazi A, Tiwari RP, Sreenivas V, et al. (2012). Psychiatric, somatic and other functional gastrointestinal disorders in patients with irritable bowel syndrome at a tertiary care center. J. Neurogastroenterol. Motil. 18, 324–331.
- Lucas M, Chocano-Bedoya P, Shulze MB, Mirzaei F, O’Reilly EJ, Okereke OI,etal.(2014).Inflammatory dietary pattern and risk of depression among women.BrainBehav.Immun.36,46–53.
- Jeffery IB, O’Toole PW, Öhman L, Claesson MJ, Deane J, Quigley EM, et al.(2012b).An irritable bowel syndrome sub type defined by species-specific alterations in faecal microbiota. Gut 61, 997–1006.
- Ait-Belgnaoui A, Durand H, Cartier C, Chaumaz G, Eutamene H, Ferrier L, et al. (2012). Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats. Psycho neuroendocrinology 37,1885 1895.
- Smythies LE, Smythies JR.(2014b).Microbiota, theimmunesystem, black moods and the brain-melancholia updated. Front. Hum. Neurosci. 8:720. doi:10.3389/fnhum.2014.00720.
- Olle B. (2013). Medicines from microbiota. Nat. Biotechnol. 31, 309–315.
- Russell WR, Hoyles L, Flint HJ, Dumas ME. (2013). Colonic bacterial metabolites and human health. Curr. Opin. Microbiol. 16, 246–254.
- Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. (2014).The gut microbiota influences blood-brain barrier permeability in mice. Sci.Transl.Med.6,263ra158.
- Harris K, Kassis A, Major G, Chou CJ. Is the gut microbiota a new factor contributing to obesity and its metabolic disorders? J Obes 2012; 2012: 879151
- Hijova E, Chmelarova A. Short chain fatty acids and colonic health. Bratisl Lek Listy 2007; 108:354-358
- Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T et al. (2013) Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell, 155:1451-1463.
- Reandon S (2014). Gut-brain link grabs neuroscientists. Nature, 515:175-177.
- Adams JB, Johansen LJ, Powell LD, Quig D, Rubin RA (2011) Gastrointestinal flora and gastrointestinal status in children with autism comparisons to typical children and correlation with autism severity. BMC Gastroenterol, 11:22.
- Finegold SM, Dowd SE, Gontcharova V, Liu C, Henley KE, Wolcott RD et al. (2010) Pyrosequencing study of fecal microflora of autistic and control children. Anaerobe, 16:444-453.
- Macfabe DF (2012) Short-chain fatty acid fermentation products of the gut microbiome: implications in autism spectrum disorders. Microb Ecol Health Dis, 23:19260.
- Manach C, Scalbert A, Morand C, Remesy C, Jimenez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr 2004;79:727–47.
- D’Archivio M, Filesi C, Di Benedetto R, Gargiulo R, Giovannini C, Masella R. Polyphenols, dietary sources and bioavailability. Ann Ist Super Sanita 2007;43: 348–61.
- Jacobs DM, Gaudier E, van Duynhoven J, Vaughan EE. Non-digestible food ingredients, colonic microbiota and the impact on gut health and immunity: a role for metabolomics. Curr Drug Metab 2009;10(1):41–54.
- Kutschera M, Engst W, Blaut M, Braune A. Isolation of catechin-converting human intestinal bacteria. J Appl Microbiol 2011;111:165–75.
- Jennings A, Welch AA, Fairweather-Tait SJ, Kay C, Minihane AM, Chowienczyk P, et al. Higher anthocyanin intake is associated with lower arterial stiffness and central blood pressure in women. Am J Clin Nutr 2012;96(4):781–8.
- Cassidy A, O’Reilly ÉJ, Kay C, Sampson L, Franz M, Forman JP, et al. Habitual intake of flavonoid subclasses and incident hypertension in adults. Am J Clin Nutr 2011;93(2):338–47.
- Hooper L, Kay C, Abdelhamid A, Kroon PA, Cohn JS, Rimm EB, et al. Effects of chocolate, cocoa, and flavan-3-ols on cardiovascular health: a systematic review and meta-analysis of randomized trials. Am J Clin Nutr 2012;95(3):740–51.
- Chiva-Blanch G, Urpi-Sarda M, Ros E, Valderas-Martinez P, Casas R, Arranz S, et al. Effects of red wine polyphenols and alcohol on glucose metabolism and the lipid profile: a randomized clinical trial. Clin Nutr 2012, http://dx.doi.org/10. 1016/j.clnu.2012.08.022
- Chiva-Blanch G, Urpi-Sarda M, Ros E, Arranz S, Valderas-Martinez P, Casas R, et al. Dealcoholized red wine decreases systolic and diastolic blood pressure and increases plasma nitric oxide: short communication. Circ Res 2012;111(8):1065–8.
- Zamora-Ros R, Agudo A, Luján-Barroso L, Romieu I, Ferrari P, Knaze V, et al. Dietary flavonoid and lignan intake and gastric adenocarcinoma risk in the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Am J Clin Nutr 2012;96(6):1398–408.
- Hanhineva K, Törrönen R, Bondia-Pons I, Pekkinen J, Kolehmainen M, Mykkänen H, et al. Impact of dietary polyphenols on carbohydrate metabolism. Int J Mol Sci 2010;11(4):1365–402.
- Bowey E, Adlercreutz H, Rowland I. Metabolism of isoflavones and lignans by the gut microflora: a study in germ-free and human flora associated rats. Food Chem Toxicol 2003;41:631–6.
- Massot-Cladera M, Pérez-Berezo T, Franch A, Castell M, Pérez-Cano FJ. Cocoa modulatory effect on rat faecal microbiota and colonic crosstalk. Arch Biochem Biophys 2012;527(2):105–12.
- Yamakoshi J, Tokutake S, Kikuchi M. Effect of proanthocyanidin- rich extract from grape seeds on human fecal flora andfecal odor. Microb Ecol Health Dis 2001;13:25–31.
- Tzounis X, Rodriguez-Mateos A, Vulevic J, Gibson GR, Kwik-Uribe C, Spencer JP. Prebiotic evaluation of cocoa-derived flavanols in healthy humans by using a randomized, controlled, double-blind, crossover intervention study. Am J Clin Nutr 2011;93(1):62–72.
- Tzonuis X, Vulevic J, Kuhnle GG, George T, Leonczak J, Gibson GR, et al. Flavanol monomer-induced changes to the human faecal microflora. Br J Nutr 2008;99:782–92.
- Molan AL, Liu Z, Kruger M. The ability of blackcurrant extracts to positively modulate key markers of gastrointestinal function in rats. World J Microbiol Biotechnol 2011;26:1735–43.
- Viveros A, Chamorro S, Pizarro M, Arija I, Centeno C, Brenes A. Effects of dietary polyphenol-rich grape products on intestinal microflora and gut morphology in broiler chicks. Poult Sci 2011;90:566–78.